新研究探討歐盟法規對醫療3D打印的影響
魔猴君 知識堂 254天前
醫療3D打印市場近年來增長迅速。其中包括歐盟,預計到2029年,整個醫療保健添加劑制造市場將以15.4%的復合年增長率(CAGR)增長。考慮到歐洲專利局去年發現國際專利族在3D打印技術以每年26.3%的速度增長,其中近五分之一是在2001年至2020年間在衛生領域完成的。但是否還有因素仍在減緩其增長?
城市法學院法學高級講師馬克·米勒博士的新研究似乎表明了這一點。在《歐盟醫療3D打印的核心法律挑戰》一文中,Mimler與來自不同大學醫院以及機械工程系的其他合作者一起,試圖根據醫療器械法規(MDR)檢查歐盟立法和判例法,關于3D打印設備的上市前批準和上市后責任相關問題。結果似乎表明,這一領域的灰色地帶確實阻礙了醫療3D打印的發展,需要做更多的工作來澄清這些問題。
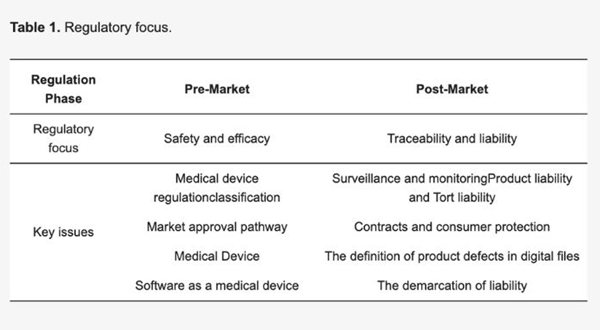
該研究重點關注3D打印醫療設備的上市前和上市后法規(圖片來源:Mimler等人)
歐盟法規是否會損害醫療3D打印的發展?
正如城市法學院的新聞稿所詳述,結果根據上市前和上市后狀態進行劃分。在審視上市前法規時,研究人員重點關注了歐盟的“定制設備豁免”,該豁免允許根據授權人員撰寫的描述制造的設備繞過CE標記等要求。雖然這對3D打印來說似乎是積極的,但“患者友好型”設備(為特定患者制造的)不屬于此豁免范圍,這一事實為3D打印醫療設備創造了一個灰色地帶。特別是因為這種區別對于“大眾個性化”設備來說并不存在。
因此,使用增材制造制造的設備的監管合規性是不確定的。盡管醫療機構和醫院內的3D打印設備的工業制造可能屬于醫療機構MDR豁免范圍,但這并不適用于其他企業,這一事實進一步加劇了這種混亂。這使得機構和小型企業很難應對定制3D打印設備的監管環境。
這還只是上市前的批準,對于醫療保健領域的3D打印來說,上市后的監管似乎也并不明確。由于歐盟對醫療器械的上市后監測和控制采取更嚴格的方法,因此MDR中3D打印器械的產品責任尚不明確。這是由于醫療疏忽和產品疏忽之間的界限模糊所致。
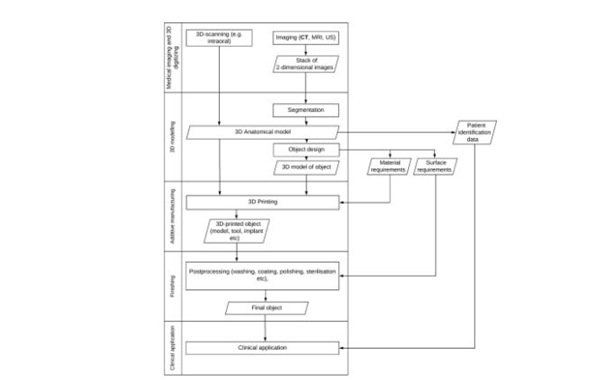
3D打印醫療設備流程的分散性質(如上所示)可能會導致上市后監管的混亂和問題(圖片來源:Mimler等人)
作者認為,這抑制了該領域的創新,因為外科醫生、第三方制造商和內部制造商等各方可能會對3D打印設備植入患者體內后出現的任何缺陷承擔責任。而這種混亂的直接原因是由于3D打印的分散性,導致不清楚到底是誰的制造商。數據保護和知識產權法的不確定性只會讓事情變得更加復雜。
最終,研究人員指出,重新審視他們認為MDR下與3D打印設備相關的保守且模糊的要求非常重要。他們認為,目前該系統抑制了該領域的創新,并延遲了對新患者的護理,因為參與者可能無法適應定制設備的當前監管環境,而且大量的文檔也減慢了上市時間。
編譯整理:3dnatives