3D打印在醫療領域的標準化
魔猴君 行業資訊 875天前
3D打印是一種以數字模型為基礎,將材料逐層堆積制造出實體物品的新興制造技術,該技術將對傳統的工藝流程、生產線、工廠模式、產業鏈組合產生深刻影響,是制造業有代表性的顛覆性技術。隨著歐盟 3D打印標準化路線圖的發布,國際組織關于3D打印一系列標準的制定,以及美國FDA關于3D打印技術文件等一系列規范的出臺,3D打印逐漸擁有了自己的通用語言和方向。
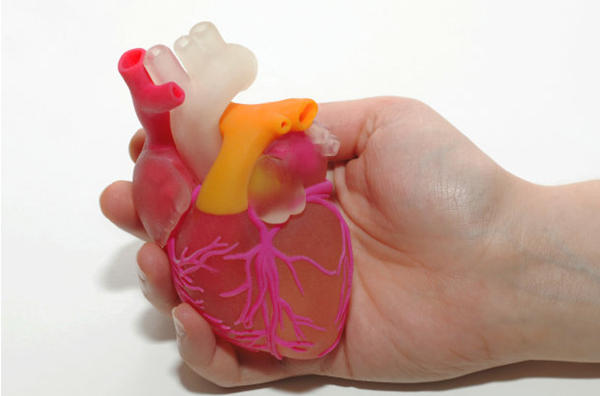
3D打印技術在醫療器械研發和制造方面的應用,不斷為醫療器械的創新發展賦能,形成了“3D打印醫療器械”產品,并在近5年逐步得以廣泛應用。3D打印醫療器械主要使用金屬、聚合物等材料,可實現器械的個性化定制和精密微觀結構的制造,然而,3D打印帶來“個性化”的同時也帶來了獨有的風險,傳統對于標準化產品的監管方式可能難以適用,同時對3D打印醫療器械的工藝、質量和風險也缺乏分析和評價方法及標準,使3D打印醫療器械的監管面臨諸多挑戰。
建立醫用3D打印產品的認證標準、法規及評價體系
為實現醫用3D打印產品的后期產業應用,各相關機構應通力合作,并且上層建筑需發揮關鍵的主導作用。
醫用3D打印的首個突破發生在骨科和牙科領域,并在這些領域正逐漸成熟。因此,早在2010年就針對骨科和牙科產品提出了3D打印醫用植入物法規。
目前,國家藥品監督管理局針對臨床應用已批準四種3D打印標準產品。國家藥品監督管理局優先考慮將其用于成熟或已經驗證過的領域,如骨科和牙科領域,并由不同省份制造定制產品的部件。
因增材制造產品包括定制產品,所以國家藥品監督管理局計劃建立一套完整的評估系統。目前,國家藥品監督管理局已制定了40項關于獲得醫療器械注冊證的指導原則,其中7項原則與增材制造有關。未來將建立相關的標準體系、監管體系、指導原則、注冊技術文件和信標體系,以重點發展臨床應用并取得突破。
我國《醫療器械生產監督管理辦法》將醫療器械的安全性和有效性列為首要的要求。目前,美國食品藥品監督管理局(FDA)主要依據合理裁定和有效的科學依據控制風險并確保醫療產品能安全有效應用,從而改善公眾健康。對于增材制造領域的新型醫療器械,需要建立相應的監管科學來驗證注冊產品的性能。注冊前需要完成的重要任務包括開展多中心臨床試驗和醫學研究,以及生產經過總結和同行評審并通過科學類出版物發表的產品,從而為臨床實踐提供重要依據。這類研究和生產將有助于創新產品的研發,并且便于在產品的臨床應用期間對整個使用過程進行監測。
四川大學醫療器械監管科學研究院是全球首個處理醫療器械相關監管事務的學術機構,其任務是通過預驗證和風險控制建立醫療器械的監管科學。這項監管科學應根據用戶、產品研發人員和企業風險控制等背景信息涵蓋醫療產品的整個生命周期。
針對定制產品制定的國內法規和國際法規之間存在差異。在英國,關于定制設備的核心管理理念如下:除與材料相關的事項外,增材制造的整個生產過程均由外科醫生負責,包括對臨床患者的計算機體層成像(CT)或磁共振成像(MRI)圖像數據采集、制造、臨床醫師確認以及隨后的臨床應用。
我國企業關注的焦點是在上市前獲得國家藥品監督管理局頒發的注冊證書。英國的現狀表明,我國應盡快針對定制的醫療器械發布明確的注冊指南,并加快臨床轉化。相關注冊指南應兼顧技術可行性以及為各方創造實際利益——尤其是患者。醫用增材制造的可重復性以及制造成品(無論用于人類、動物模型還是細胞模型)的特征均須按照標準化方式實現。在未來的研發和臨床應用中,這項課題值得進一步思考和探討。
所有新技術和新型材料——尤其是3D打印的三類醫療產品——在臨床應用前均需實施系統性評估,并通過監管機構審批。醫用增材制造技術仍處于探索起步階段。目前,3D打印技術在骨科和牙科領域的臨床應用中仍需克服幾大難題:風險擔責界定不明,臨床注冊和審批時間過長。這是因為難以評估此類產品的預期臨床效果,3D打印制造的產品尤其如此。此外,產品質量控制體系尚未完善。雖然臨床前科學家發起的臨床研究目的并非臨床注冊,但相關管理流程和質量控制體系必須滿足相應的外科醫療要求。
3D打印醫療器械質量控制要點
對于3D打印醫療器械產品的性能,安全性是最重要的一方面。要確保安全性,就要從前期的設計和制造階段就對各個環節進行把控,即產品的質量控制。3D打印醫療器械的質量控制涉及制造過程和生產管理中的許多環節,包括醫工交互、原材料質控、打印設備管理、加工工藝參數、后處理工藝管理、成品質量控制,每個環節都有不同的質量控制要點。
1 醫工交互
醫工交互是患者匹配式3D打印醫療器械不同于非定制式醫療器械的突出特點之一,其中的規范性、交互信息的有效性、密切的配合和良好記錄的文件顯得非常重要。應準確界定醫工交互全過程的關鍵環節及其構成要素,并研究如何對這些要素實施有效的控制。
《無源植入性骨、關節及口腔硬組織個性化增材制造醫療器械注冊技術審查指導原則(2019年第70號)》也明確了其中的產品應滿足醫工交互6個方面的要求,包括設計軟件?打印設備?原材料?打印工藝驗證?后處理方法及驗證?產品測試,并要求從個性化設計?產品交付和產品使用三方面對增材制造醫療器械醫工交互能力進行確認。
2 原材料質量控制
原材料的質量控制是保證打印產品質量的基礎,其純度和性能更顯得至關重要。當前增材制造醫療器械主要涉及的原材料是用于3D打印的金屬粉末,包括醫用鈦合金、醫用純鉭和醫用鎳鈦合金。
金屬3D打印原材料的形態是球形粉末狀,因此,要從圓形度、球形度、流動性、振實密度、松裝密度等方面對原材料進行表征,并且驗證其物理與化學性能是否滿足醫療器械生產的要求。此外,對于3D打印回收的舊粉末的使用,要求生產商對混用的粉末進行說明和驗證,驗證打印環境對粉末的影響、論證工藝穩定性和臨床可接受性,通過這些情況來判斷粉末回收對于打印的過程和結果的潛在影響,否則不允許使用回收的粉末材料。
3 打印設備管理
打印設備是實現3D打印醫療器械生產的重要硬件。設備運行的穩定性和打印工藝的穩定性決定了產品的批間差異是否在可接受范圍內。打印設備的打印參數要有嚴格的驗證程序,確保打印工藝的可實現性和穩定性。對于設備改裝的合理性和效果也要經過驗證 。
4 加工工藝驗證和后處理工藝管理
打印的初步產品需經過必要的后處理,如消除熱應力,表面粗糙度處理、去除粉末殘留。這些后處理是保證產品的合理力學性能和生物相容性的重要保證。目前,中檢院組織制定的標準《醫用增材制造 粉末床熔融成型工藝金屬粉末清洗及清洗效果驗證方法》處于報批階段,主要針對“殘留金屬粉末常用清洗流程”和“清洗效果驗證方法”這兩方面的技術內容建立標準。制造商可根據其中的規定來實施清洗流程并證明清洗合規性。
5 成品質量控制和產品應用風險評價
3D打印醫療器械除了在制造完成后要滿足性能要求外,還需要考慮與人體相互作用時可能對人體健康造成的影響。以3D打印鈦合金植入物為例,針對金屬離子析出評價,中檢院制定了《增材制造醫療產品3D打印鈦合金植入物金屬離子析出評價方法》,目前已完成報批。標準規定了用于測試的樣品形貌,以及需檢測的金屬離子(Ti、Al、V以及雜質元素Fe)等內容。
其他需要關注的包括:對物理性能(機械性能和疲勞性能)、化學性能(化學成分控制、顯微組織)和生物相容性的控制。生物相容性應按照GB/T16886系列標準的要求進行全面的評價。
一系列政策推動3D打印技術與實體經濟融合
2015年2月,工業和信息化部、發改委、財政部聯合發布《國家增材制造業發展推進計劃(2015—2016年)》,提出到2016年中國要初步建立較為完善的增材制造產業體系,整體技術水平保持與國際同步。
2015年5月,國務院印發《中國制造2025》規劃,明確將增材制造產業作為發展重點,推動中國3D打印技術和裝備的研發和應用。作為智能制造的重要內容,3D打印技術在中國制造2025“1+X”多個規劃中被提及。相關 3D打印領域企業也將獲得國家特別上市制度支持。
2016年12月,工業和信息化部批復國家增材制造創新中心,由西安交通大學、北京航空航天大學、西北工業大學、清華大學和華中科技大學這5所高校及裝備、材料、軟件及研發等13家重點企業共同組建,開展3D打印共性技術研究、標準制定及產業化。同時,國家質量監督檢驗檢疫總局批準了無錫市產品質量監督檢驗中心籌建國家增材制造產品質量監督檢驗中心,開展相關產品檢測、認證等服務。
2017年11月,工業和信息化部等12部門印發《增材制造發展行動計劃(2017—2020年)》,明確提出到2020年,中國增材制造產業年銷售收入超過200億元,年均增速在30%以上。3D打印技術的發展需要材料、工藝裝備、核心部件等關鍵技術研發及產業化能力的提升,以及推進在重點行業的創新應用。
行動計劃對醫療 3D打印技術的發展明確了方向,提升醫療增材制造專用材料的質量和工藝性能,完善個性化醫療器械的材料設計和微結構設計技術,提高增材制造裝備及核心部件質量性能及可靠性,同時,要積極探索“3D打印+醫療”示范應用新模式,針對醫療領域個性化醫療器械、康復器械、植入物、軟組織修復等需求,推動完善個性化醫用增材制造產品在分類、臨床檢驗、注冊、市場準入等方面的政策法規,研究確定醫用3D打印產品及服務的醫療服務項目收費標準和醫保支付標準。同時,建立完善增材制造標準體系、檢測和認證體系,以及人才培養體系。
3D打印醫療器械注冊技術規范為市場準入開辟通道
3D打印醫療器械的臨床使用一直受到法規政策的限制,各個國家都沒有相關的標準進行審批注冊,大部分3D打印產品主要包括腫瘤、器官模型及手術導板等臨床輔助產品,只需要備案,不在審批注冊嚴格監管范圍內。2017年,美國食品和藥品管理局(FDA)發布了《3D打印醫療器械技術指導意見》,以規范相關產品的生產制造活動,明確了醫療產品的增材制造流程和相關檢測的操作規范,對3D打印的方法、設計、工作流程,制造工藝、材料控制、后處理、測試以及質量管理等基本流程提出了具體技術要求,為3D打印醫療器械審批注冊提供了依據,為產品市場準入開辟了通道。
3D打印醫療器械的基本流程 放大圖片
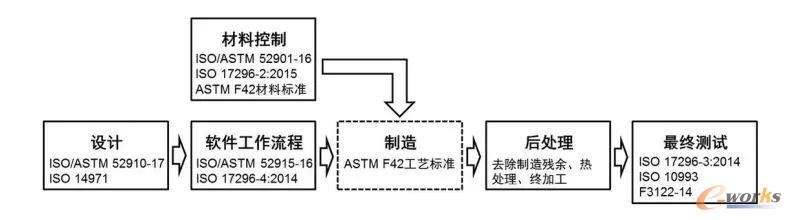
3D打印醫療器械的基本流程
2018年2月,國家食品藥品監督管理總局(CFDA)發布了《定制式增材制造醫療器械注冊技術審查指導原則》的征求意見稿,明確了注冊審批相關操作和資料要求,對3D打印產品的用途、產品性能、臨床試驗、質量管理等提出了具體要求,特別強調了醫工交互的條件與能力確認,對3D打印醫療器械的生產和驗證過程,包括對打印設備、工藝、后處理、原材料和最終產品的測試要進行嚴格控制,對于設計開發、產品交付、產品使用的人員資質與能力進行確認,保障3D打印產品在臨床的安全、有效使用,此外,強調在產品全生命周期中要對患者的健康狀況建立數據庫,評價器械的耐久性以及醫療事故的追溯性。該審批注冊規范的出臺意味著中國醫療領域3D打印行業即將擁有正式的技術審查指導原則,為3D打印醫療器械注冊、審批、上市掃除障礙。
展望
總的來說,“3D打印醫療器械標準化”可拆分為三個概念:3D打印、醫療器械、標準化。3D打印是制造產品的技術,醫療器械是產品,而標準化是使產品滿足要求。只有滿足要求的產品才能實際應用,實現產品的意義。
目前來說,基于標準化工作的系統性和廣泛性的特點,要繼續推進3D打印醫療器械標準化,就需要同步推進許多方面的工作,包括:1)推進中國增材制造技術產業化進程;2)加強中國與其他國家及組織在標準化工作方面的交流與合作;3)領域各方為中國監管部門建立相關法規提出建設性意見;4)領域各方為制定特殊風險分析、風險控制等法規性指導原則提供技術支持;5)監管部門進一步建立技術和方法、原材料、設備和工藝的標準。
從中可以看出,產業和標準是相互依賴的,產業不能脫離標準的指導,標準也不能脫離產業成為空中樓閣。其次,生產、教育、科研、檢驗機構、醫學單位、標準化機構、監管部門都是這一領域的重要組成,各方根據不同的分工在功能與資源優勢上實現協同化和集成化,共同推進增材制造醫療器械標準化工作發展。
在“2020年全國醫療器械安全宣傳周”活動中,藥監局已經展示了關于增材制造醫療器械產品評價的最新構成要素所形成的質量控制的八維度,包括性能、特征,在大層面上又分成三大類,分別是基于產品、基于制造、基于用戶的方法,相對綜合和系統性地保障3D打印醫療器械的質量并滿足用戶需求。
這些可以作為切入點幫助醫療器械企業更好地從零開始理解看似復雜的標準化工作。中國有一句古話叫做“以不變應萬變”,其含義反映在標準化工作中就是,盡管產品是個性化的,但工作流程和操作方式仍然可以是標準化的,以標準化的流程來規范各種各樣的個性化產品。理解了這些概念,再加上不斷熟悉監管法規和3D打印技術,企業就可以更好地根據標準化的要求來革新自己的產品,真正使用新的技術帶來新的產品,并滿足審批要求。
將產品的發展拓展到更長的過程,從實驗研究到生產應用,即使是在實驗室中,對3D打印醫療器械的研究,也應將產業化和臨床轉化的意識作為一個重要的原則貫穿研發過程,不能僅僅為了發表論文而只讓產品停留在科研階段。類似地,從科研到產業階段,對于醫療器械企業的要求是,當研發出一個3D打印醫療器械產品時,不能把獲得監管部門的批準和認證作為最終目標。產品獲證只是應用的開始,應用的有效性才是醫療器械產品最終的追求。
對于3D打印醫療器械監管和標準化的未來發展,“質量”和“風險”仍將是該領域繼續探索的兩大關鍵詞,而首要任務仍然是建立更完善的指導原則、標準和監管法規體系。對3D打印醫療器械標準化和監管體系的建設已經被列為中國十四五期間的重要任務和規劃之一。這些體系在橫向上可以不斷拓展覆蓋面廣度,使標準覆蓋更多種類的技術和產品,而在縱向上不斷拓展深度,對具體產品和技術延伸和完善更多細節。
來源:榮格增材制造