3D打印人造子宮來了,未來女性也不用親自懷孕了?
魔猴君 行業資訊 1270天前
早產兒是指胎齡小于37周的新生兒。近年來中國早產兒的發病率呈上升趨勢,約為7%。早產兒的存活率與胎齡有關,胎齡越小,體重越輕,死亡率越高。出生時體重不足1500克的嬰兒死亡率約占新生兒期死亡總數的50%,伴發后遺癥的可能性也相對較大。如何提高早產兒存活率減少并發癥是急需解決的問題。另外對于患有子宮疾患的女性,懷孕生子成了奢望。如果在體外能夠模擬子宮內環境使胚胎發育,將會同時解決以上兩大問題。科學家們提出了人造子宮的設想,人造子宮是通過模擬哺乳動物子宮和卵生動物卵的條件,使受精卵在人造環境下發育,從而擺脫對母體的需求。目前已經取得一定進展,未來人造子宮應用的路還有多遠呢?
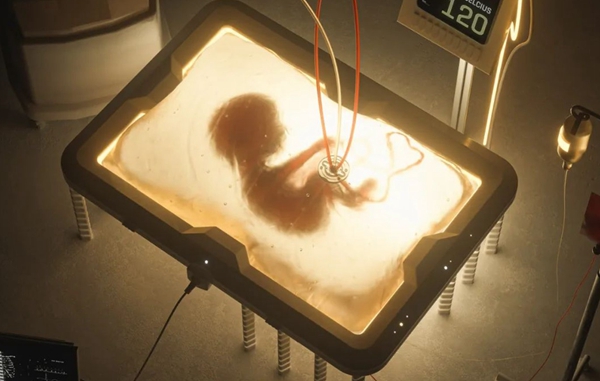
來源:neo.life
人造子宮已在羊身上實現
早在1923年,霍爾丹在劍橋大學舉行的一次講座中首次對人造子宮進行深入探討后,各國科學家就開始研究胚胎脫離母體生長的可能性。1954年,伊曼紐爾·格林伯格首次設計了人造子宮的裝置并申請了專利。設計包括一個用來放置充滿羊水的胎兒的水箱、一個連接到臍帶的機器、血泵、一個人造腎臟和一個熱水器。這僅僅是一個粗糙的設想。

1987年,日本順天堂大學教授桑原義典(Yoshinori Kuwabara)開發了一種宮外胎兒孵化系統EUFI(Extrauterine Fetal Incubation System)。宮外胎兒孵化系統有與母山羊體內相似的人造羊水環境,在前期實驗的基礎上研究人員將培養時間成功延長至三周直到山羊足月。但因山羊胎兒在活動時會夾住或拉出導管,因此桑原用肌肉松弛劑使它們癱瘓,但是松弛劑讓胎兒無法正常呼吸,當研究人員在四周后移除呼吸機時,山羊在數小時內死亡。
2017年,費城兒童醫院的阿南·弗雷克(Alan Flake)團隊在《自然通訊》雜志上發表了開發的“人造子宮”動物試驗,成功將發育到中期(相當于人類妊娠周期22-24 周)的早產山羊胎兒在“人造子宮”中維持了4周撐過危險期順利存活。弗雷克同樣將胎齡更小的羊(105 至 108天)在體外成功培育了4周(最終因動物協議的限制而停止)。

這種人造子宮確切地說是一種用特殊材質制成的生物袋,生物袋模擬母羊子宮,其中充滿了羊水,在生物袋外部配置機器胎盤,機器胎盤的血管與早產小羊的臍帶連通。人造子宮接有專門管道,每天注入定量羊水,以確保生活在其中的早產羊羔如同懸浮在母體的子宮環境內。含有養料和氧氣的新鮮血液不斷輸送到羊羔體內,羊羔的心臟也將含有二氧化碳和其他代謝物質的陳舊血液擠壓到機器胎盤中,機器胎盤將血液更新之后再回輸到羊羔體內。

在人造子宮孕育期間,這些早產羊羔全部正常發育,血壓和其他健康指標穩定,沒有其他并發癥。有一部分生下的小羊生長超過一年,經過各項指標檢測,結果也與正常生殖的小羊沒有什么差異。這項技術如果能夠應用于人類,將會極大提高早產兒的生存機會。我國也在進行人造子宮的嘗試。2020年12月,鄭州大學第一附屬醫院首次取得人造子宮胎羊體外培育的成功,該項研究是由胸外科、產科以及體外支持中心ECMO團隊聯合推進的。這項研究填補了我國在體外培育的空白。
人造子宮,見證小鼠胚胎早期完整發育
2021年3月《自然》雜志發布以色列魏茨曼科學研究所最新研究,該研究利用“人造子宮”,成功培育出數百只小老鼠,且小鼠所有器官發育指標都正常。
這項研究有什么 “過人”之處?
前述研究僅限于實驗室環境下的早期胚胎分裂、短期發育,或待器官形成后從子宮中取出胎兒并在實驗室中繼續生長。而這次研究所關注的是“胚胎早期完整發育”,見證其如何發育成生命體。研究團隊從母鼠體內提取出孕育只有7.5天、出現內細胞團分化、形成外胚層和原始內胚層的胚胎,此時胚胎僅由250個細胞組成。將胚胎置入“人造子宮”環境中,“人造子宮”包含保溫箱、營養物質和通風系統等部分。看似簡單的構想和操作,從概念到成功運轉耗時7年。
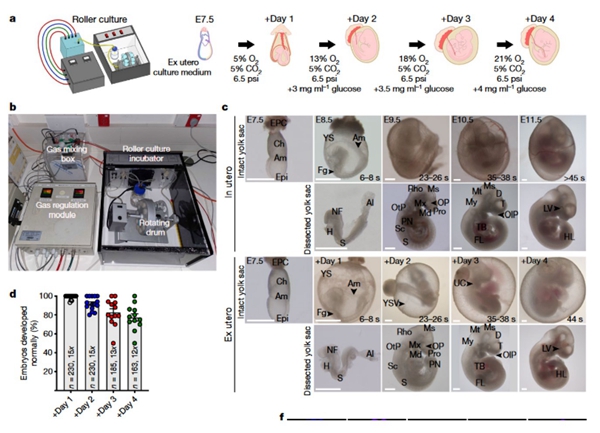
圖b轉輪中的玻璃瓶是孕育小鼠胚胎的“子宮”,里面裝滿滋養胚胎細胞的特殊液體,其為胚胎發育提供必需的營養成分、激素和糖分。轉輪轉動則能避免胚胎附著在玻璃瓶側面,避免胚胎變形或停止發育。
圖c顯示“人造子宮”培養的小鼠胚胎從細胞球長成小鼠胎兒,出現所有器官,心臟有跳動,大腦完全發育。
這一技術同時也為研究胚胎發育打開新的大門,該技術能避免子宮內部成像限制,使研究者直接觀察胚胎發育過程,或可應用于受精卵移植、流產等研究。
3D打印子宮是否可行呢?
上述人造子宮可以模擬子宮內環境,但畢竟是生物袋,那么真正的組織型人造子宮是否能夠實現呢?
與之前依托機械的模式完全不同,2001年,康奈爾大學婦產科劉洪清教授體外重新構建出“子宮”這個器官。
先共同培養受精的人類卵子與子宮內膜細胞,使子宮內膜細胞先在膠原蛋白基質中生長,讓細胞形成類似于子宮內膜組織的多層栓塞,最終筑造出一個由膠原質和軟骨素構成的,可以被生物分解的子宮形狀的支架,然后在上面“播種”子宮內膜細胞,當穩定后將用作支架的物質分解掉,構建了三維的“人造子宮”。由于美國法律規定體外受精的胚胎發育不能超過14天,最后實驗在第6天就終止了。但這是首次實現子宮內膜的體外重建。
據《科學》雜志公布,美國卡內基-梅隆大學科學家已經利用3D生物打印機,用人體膠原蛋白為原料,成功打印出了可正常工作的心臟組織,其精細度可達20微米。打印出來的心臟組織可以嵌入活體細胞和毛細血管,并且開始跳動,泵出血液。
并且,深圳先進技術研究院也在2017申請了 “3D打印人造子宮內膜及其制備方法和應用”的專利。該發明涉及生物技術領域,具體涉及3D打印技術制備的人造子宮內膜。通過3D生物打印技術,將生物相容性支架與子宮內膜基質細胞/上皮細胞制成具有生物活性的人造子宮內膜。
可見,3D打印子宮或許在未來可以實現。

雖然人造子宮已經取得不錯的進展,但從技術層面看,人造子宮現在還非常不成熟,類似“卵化器”,只能在孕育的最后階段,發揮子宮的部分功能,提高早產的存活幾率,這些并不足以支撐整個生育過程。其次,胎兒在母體生長發育的過程中,不僅僅是營養獲取、激素調節,可能還有情感交流等,母體外的胚胎和正常生育的胚胎究竟有什么不同,目前人類還知之甚少。
和其他人造器官相比,人造子宮面臨更多的倫理爭議。人造子宮是解決早產兒存活率的問題,給不孕女性提供生育可能?還是用來方便不想“親自”孕育的女性?
技術的使用不當,也可能引發種種不可預期的社會問題。技術的進步,應當始終服務于人類的福祉。我們還需要更多的時間進行倫理學上的思考及辯論。
來源:https://www.3ddayin.net/xinwenpindao/guowaikuaidi/41063.html